YouTubeよりコピー
本日のお題は、2023年1月8日に掲載された日経電子版記事「攻めなき日本の薬事行政、名ばかりだった「緊急」」です。
いつものように、著作権を気にしながらカット&ペーストで、そっくりそのまま以下ご紹介します。
それにしても、日本の薬事行政は薬害エイズ問題が発端なのか、新薬承認に対して(責任は取らないくせに)過剰に厳しく検証するようになったのかもしれません。
うがった見方をすると、承認を厳しくする方が天下り先を製薬会社に確保するのに都合が良いからなのでは...
先日、エーザイのアルツハイマー新薬「レカネマブ」が米国のFDA(米食品医薬品局)に暫定的に迅速承認されたというニュースが読売新聞のトップを飾りましたが、エーザイはこれから日本に申請するようです。
エーザイは表立っては言えないでしょうけど、日本で新薬を申請するより、海外で先ず申請する方がスムーズに事が運ぶと思っているのでしょう。
厚生労働省には、治療を熱望している患者の気持ちを慮るより、もっと重要な判断基準(前例がないのでNG)があるようです。
以下、日経電子版記事より
攻めなき日本の薬事行政、名ばかりだった「緊急」
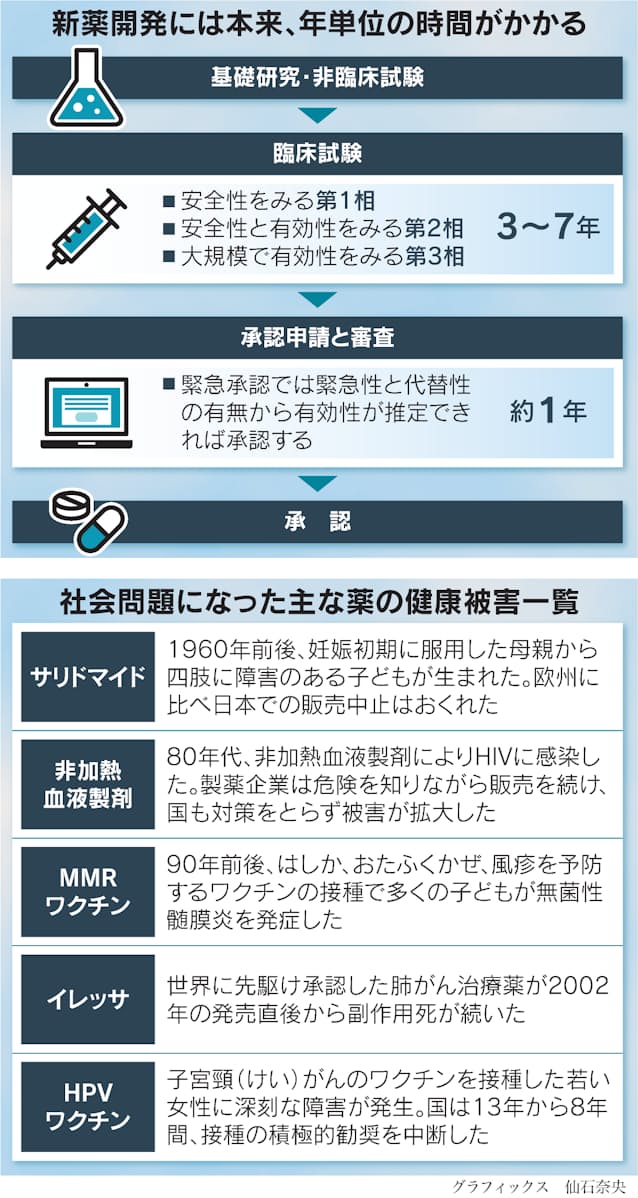
昨年5月に鳴り物入りでできた薬の緊急承認制度は、やはり絵に描いた餅だったのか。塩野義製薬の新型コロナウイルス向け飲み薬「ゾコーバ」が11月下旬に製造・販売にこぎ着けた。審査に時間がかかり、実態は通常の承認と大して変わらなかった。感染症有事でも、攻めなき日本の薬事行政。これでは国内発の新薬創出はおぼつかない。

11月22日夜、ゾコーバの緊急承認の可否を判断する厚生労働省の薬事・食品衛生審議会の薬事分科会と医薬品第2部会の合同会議が開かれた。承認審査は非公開が常だが、この日はウェブ中継された。委員の一人、島田真路・山梨大学長が再三、反対意見を述べた点を除けば、予定調和で進んだ。
島田氏が問題にしたのは代替性だ。緊急承認制度では「当該医薬品の使用以外に適当な方法がない」ことが前提条件になる。米社製の2種類の飲み薬がすでに使え、余っている。なぜ新たに国産品が必要なのか。事務局となる厚労省から明確な回答はなかった。
予定の2時間がたとうとしたところで、座長を務めた太田茂・和歌山県立医大教授が議論を打ち切り、議決を呼びかけた。島田氏を除くと、委員の大半は沈黙のまま。「賛成が多数と認めたいと思います」の言葉で締めくくられ、ゾコーバの製造・販売が決まった。
薬事行政を担う厚労省の薬系技官から、アカデミアの世界に転じた小野俊介・東京大准教授は長年、日本の薬の審査会合を「結論ありきの神事」と批判してきた。
製薬企業がお金と時間をかけて実施した臨床試験(治験)から導いた安全性や有効性が、科学的に妥当かどうかを判断する実行部隊は、厚労省所管のPMDA(医薬品医療機器総合機構)。その結果を厚労省の審議会で専門家たちが議論するのだが、通常は「しゃんしゃん」で終わる。いわゆる齟齬(そご)なき二重行政である。
「神事」という言葉には、儀式とともに無謬(むびゅう)性の意味合いも含む。薬の承認という絶大な権限をもつ厚労省の薬系技官たち。一度認めたら何があっても取り消すという想定はしない。
サリドマイド、肺がん治療薬「イレッサ」、子宮頸(けい)がんワクチン――。幾度となく医薬品を巡る健康被害が大きな社会問題となり、その都度、厚労省はやり玉に挙げられた。その呪縛はいまも解かれていない。
結局、「ゼロリスク」を金科玉条とする。海外で先に承認されれば「右へならえ」できるのに、日本発でしかも最初の薬やワクチンとなると、どうしても臆病になる。
対照的なのが、米食品医薬品局(FDA)だ。公衆衛生上の非常事態宣言下における緊急使用許可(EUA)とはあくまで「仮免許」。安全に問題が生じたり、ウイルスが変異して効果が薄れてしまったりすると、取り消しも辞さない。米国ではコロナ禍で20近くの薬やワクチンが承認されたが、4製品はその後、許可を撤回された。
日本は薬の有効性について科学的根拠(エビデンス)を絶対視する傾向にある。もちろんプラセボ(偽薬)を使った無作為化比較試験(RCT)と呼ばれる方法で判断するのが王道だが、緊急時ならそれにこだわる必要もあるまい。
厚労省で医薬・生活衛生局長を務めたボストンコンサルティンググループの武田俊彦・シニア・アドバイザーは提案する。「非常時には、薬の必要性とか、なぜあえて今投入しなければならないのか、臨床試験が不十分でも構わないか、といった様々な視点から総合的に判断する仕組みがあっていい」
コロナ禍、日本では製薬会社がPMDAなどと製造・販売に向けて詳細に協議する機会もなかった。治験が順調に進んだとして規制当局が首を縦に振らないかぎり、薬は製造も販売もできない。製薬会社にとって経営の生殺与奪の権を握られている以上、対等な関係を築くことも難しい。
「治験の目標設定をどうすれば承認につながるかといったアドバイスをFDAからは得られた。PMDAや厚労省から、そうした助言は一切なかった」(複数の製薬企業担当者)。緊急時だからこそ急いで新薬を生み出そうとする気概は日本の薬事行政にはない。
「レギュラトリーサイエンス」という言葉がある。直訳すると「規制の科学」。科学的に可能性があると評価した場合に、なんとか社会に生かす策を探る。日本の科学者が35年前に提唱した。規制でも調和を重んじる考え方で、今や先進国の薬事の潮流になっている。
薬やワクチンに100%効くものなどない。社会のニーズをくみ取り、リスクとベネフィットをどううまく判断するか。薬事行政にもそのしなやかさが求められる。
〈Review 記者から〉「根拠に基づく医療」にも濃淡
水際対策の緩和や隔離期間の短縮、「2類か5類か」など、日本のコロナ対策のリスク評価ではいつもエビデンスが取り沙汰された。「根拠に基づく医療」(EBM、エビデンス・ベースト・メディスン)と呼ばれる考え方で、この20年余り、医療の分野で重視されるようになった。様々な政策に当てはめた「証拠に基づく政策立案」(EBPM、エビデンス・ベースト・ポリシー・メーキング)という考え方もある。
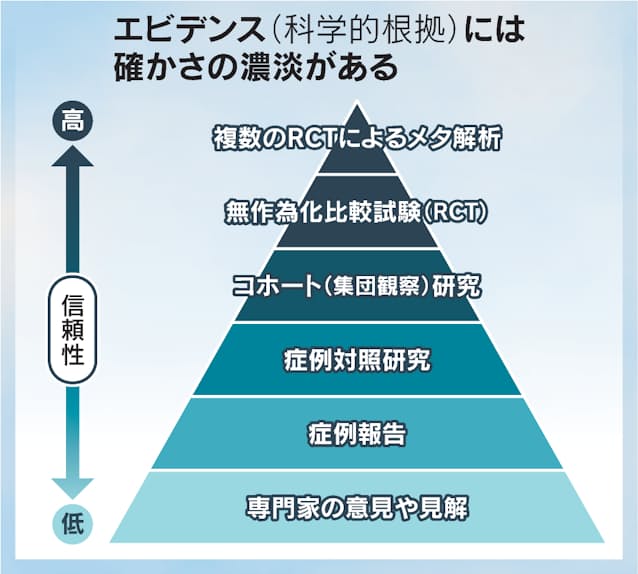
実はこのエビデンスという言葉には落とし穴がある。科学的といっても「ある」「なし」の二元論で論じることは危うい。信ぴょう性には濃淡があることを知っておくのも大切といえよう。
医薬品は健康な人の体にとっては害があるものでしかない。そのため、無作為化比較試験(RCT)という統計学によるエビデンスレベルの高い臨床試験を経て、安全性と有効性から薬として認めるか否かを決める。
このRCTも集団を相手にした研究による推定結果でしかない。例えば症状を70%減らす効果があったとしよう。あくまで平均値でしかなく、ある患者にとってはまったく効かないことだってある。
がんや自己免疫疾患、そして新型コロナの感染症もそうだが、病気を引き起こすメカニズムはとても複雑だ。医学が日進月歩で進化するとはいえ、投与すれば必ず治る類いの「特効薬」は生まれない。有効性といえどもそれは「確からしさ」での評価にすぎない。
(編集委員 矢野寿彦)
緊急承認制度
2022年5月に成立した改正医薬品医療機器法において創設された、有事における薬事ルール。米国にある緊急使用許可(EUA)制度を手本としている。日本の「ワクチン敗戦」の根幹にはパンデミックの際の医薬品承認の考え方があいまいだったこともあり、この打開策としてできた。とにかく早く承認できるよう、緊急時には薬の有効性は「確定」していなくても「推定」できればよい。にもかかわらず、緊急性とはなにか、推定とはなにかが明確化されておらず、審査が手間取った。

インターネットは今や無くてはならない世界の標準インフラですが、2000年頃からその先頭を走っていたドコモのiモード。
公式サイトは本年11月30日に終了。
iモードに遅れて参入したアップルのiPhoneは、その使い勝手の良いユーザー本位の機能が評価され、潰れかかっていたアップルをアッという間に世界の優良企業にのし上げた。
www.comfizone-japan.com Blog Feed
#斎藤知事 #斎藤元彦 Vol.14-2 Ecstasy❤ (木, 03 4月 2025)>> 続きを読む
#斎藤知事 #斎藤元彦 Vol.14-1 Ecstasy❤ (Thu, 03 Apr 2025)
>> 続きを読む
#斎藤知事 #斎藤元彦 Vol.14-1 Ecstasy❤ (Wed, 02 Apr 2025)
>> 続きを読む
#斎藤知事 #斎藤元彦 Vol.14-1 Ecstasy❤ (Tue, 01 Apr 2025)
>> 続きを読む
#斎藤知事 #斎藤元彦 Vol.14-1 春の予感♪ (Mon, 31 Mar 2025)
>> 続きを読む

コメントをお書きください